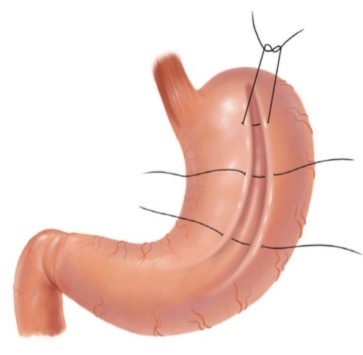
Актуальность проблемы, связанной с повышенным весом тела человека, обусловлена совокупностью причин. Распространенность данной патологии и постоянное увеличение количества страдающих пациентов имеет известный масштаб, большинством своим данная тенденция касается развитых и развивающихся стран, где имеется стремление к повышению качества жизни человека. Доказана прямая взаимосвязь и сочетание патологического влияния на организм человека, повышенного веса и таких распространенных [...]
Хирургические методы лечения ожирения
Феохромоцитома — гормонально-активная опухоль надпочечника
Феохромоцитома – это опухоль из ткани надпочечников, которая выделяет гормоны, повышающие кровяное давление. Надпочечники – это два парных органа, каждый из которых расположен над соответствующей почкой. В них образуется большое количество гормонов, регулирующих разные функции организма. Феохромоцитома может развиваться в любом возрасте, но чаще всего она возникает в 20-40 лет.Обычно феохромоцитомы доброкачественные, однако вовремя не [...]
Уникальные методы лечения рака прямой кишки — операции профессора
Рак прямой кишки выведен в отдельную нозологическую единицу, тем не менее, многие его аспекты пересекаются со злокачественными образованиями ободочной кишки, поэтому в клинической практике часто говорят о колоректальном раке. Ежегодно в мире выявляется около 800 тысяч новых случаев колоректального рака и около 400 тысяч смертей от него. Рак прямой кишки занимает третье место в структуре [...]
Удаление полипа в толстой кишке — операция, как проходит, осложнения.
Операция по удалению полипов прямой кишки (полипэктомия) необходима, поскольку колоректальный рак в 95% случаев развивается из подобных образований. Степень риска злокачественной трансформации зависит от величины, типа строения и клеточного состава патологического нароста. Своевременная диагностика позволяет удалить потенциальный рак малотравматичным методом, что подразумевает: • минимальный риск развития осложнений; • незначительную выраженность послеоперационных симптомов (боль, слабость, головокружение [...]
Хронический сальпингит и спайки маточных труб
Сальпингит, что это такое? Симптомы, причины и лечение Сальпингит — это воспаление маточных труб, которое вызвано бактериальными возбудителями. Данное заболевание является очень распространенным и встречается у 30% женщин. Протекание болезни может иметь разные уровни осложнений, поэтому выделяют несколько форм сальпингита: скрытая, острая, хроническая. Острый сальпингит характеризуется пронзительными болями в области живота, легким ознобом и всеми [...]